在药物的研究和开发中,存在大量的表面,需要考虑和量身定制其行为和性能,以便在与周围环境的相互作用中获取最佳性能。
这种典型的表面是最终产品的涂层如药物片剂,其性质显著影响药物化合物的递送和释放。 其他一些非常重要的表面是药物在配制、储存和给药阶段接触的那些表面,以及每个表面相互作用可能影响药物稳定性的情况。
(一)药物开发
QSense的纳克级别质量灵敏度为药物发现和开发提供了无限潜力。通过QSense进行的研究活动包括:
- 各种实验条件下,实时精确监测小分子药物与蛋白质、细胞膜和RNA的相互作用。[1]
- 蛋白质-蛋白质相互作用[2]
- 小分子与RNA相互作用时,RNA的结构变化[3]
(二)药物递送
QSense已被证明是一种成本效益高、时间效率高的技术,特别适用于表征脂质纳米颗粒(LNP)及其药物递送特性方面。大量文献证明QSense可以用于:
- 分析血清蛋白与脂质纳米颗粒(LNP)的结合亲和力[4]
- 生物分子(如siRNA和mRNA)在LNP上的结合与释放[5]
- 将LNP递送到目标器官[6]
- 在无细胞环境中筛选血清蛋白与LNPs的结合亲和力[7]
- 分析LNPs的表面修饰[8]
- 脂质与生物活性分子(包括药物、DNA和siRNA)的相互作用[9]
- ApoE结合后对脂质成分分布和整体LNP结构的影响[24]
- 用于存储功能化LNP的纳米孔阵列[25]
- 提高LNPs核酸载荷递送效率的LNP配方[26]
- 使用cDNA将微泡固定到支持的脂质双层上[27]
- 稳定化立方体的嵌段共聚物与生物模拟脂质膜的相互作用[28]
(三)制剂配方开发与优化、生物制药生产、贮存和给药过程中的蛋白质稳定性分析
利用QSense耗散型石英晶体微天平分析评估生物制药配方的稳定性和材料相容性
在生物制药的动态生命周期中,从初始研发创意到患者使用,稳定性和材料兼容性至关重要。在生产、储存和给药过程中生物药品与各种表面的复杂相互作用可能导致意外吸附、浓度降低或蛋白质颗粒形成等挑战。
主动筛查以降低风险
及早发现潜在问题对于避免时间表的干扰和财务损失至关重要。在开发过程中,主动筛查由表面诱导的不稳定性有助于降低后期失败的风险。QSense® QCM-D可以提供对生物制药相互作用的全面分析,提供纳米尺度的分子吸附、脱附和结构变化的深入见解,以快速检测不相容性。
QSense QCM-D作为生物制药成功的早期评估工具的关键能力
- 分析生物制药与相关表面材料的相互作用
快速评估在生物药品开发早期的生产、储存和给药各个环节中使用的材料对完整配方的影响。
- 通过主动检测不兼容性来最小化风险
快速测量候选配方在相关表面上的吸附量,并确定减轻不相容性的方法。
- 实时监测抗体和辅料的吸附情况
了解表面活性剂的作用机制及其作为稳定剂的潜力。
QSense进行配方开发评估
- 确定不同表面材料上的抗体吸附水平
- 深入了解材料表面的分子排列
- 识别哪些表面可能会引起不兼容性问题?
- 评估辅料对抗体吸附的影响
- 探索浓度、pH 值、温度、表面材料或表面活性剂类型的变化如何影响吸附水平。
阅读案例
下载白皮书,了解有关如何使用QSense耗散型石英晶体微天平技术来降低晚期发现不兼容性的风险等更多信息。
下载白皮利用QSense耗散型石英晶体微天平分析评估生物制药制剂的稳定性和材料相容性书
典型案例包括:
- 药物与聚合物、玻璃、金属和金属氧化物、硅油等表面的相互作用[10],[11],[12],[13],[14],[15],[16]
- 辅料在减少药物-蛋白质吸附到表面上的效果[17]
- 配方条件(浓度、pH值、温度等)的影响; [18]
- 界面和界面应力在生物制品开发中的影响[19]
|
药物-表面相互作用研究用QCM-D芯片列表
|
|
塑料包装
|
聚丙烯 (PP)
聚氯乙烯 (PVC)
聚对苯二甲酸乙二醇酯 (PET)
聚甲基丙烯酸甲酯 (PMMA)
|
聚乙烯 (PE)
低密度聚乙烯 (LDPE)
高密度聚乙烯 (HDPE)
线性低密度聚乙烯 (LLDPE)
|
|
玻璃容器
|
硼硅酸盐玻璃
|
苏打石灰玻璃
|
|
包装袋
|
环烯烃聚合物 (COP)
|
环烯烃共聚物 (COC)
|
|
过滤材料
|
聚偏二氟乙烯 (PVDF)
聚四氟乙烯 (PTFE)
聚碳酸酯 (PC)
|
聚醚砜 (PES)
聚对苯二甲酸乙二醇酯甘油改性 (PET-G)
|
|
预充填注射器
|
注射器 PDMS(硅油)
|
|
其他相关材料
|
聚苯乙烯
纤维素
不锈钢L605
SS2343(类似于美国标准316)
乙烯-醋酸乙烯共聚物 (EVA)
|
尼龙
聚氨酯
醋酸纤维素
聚丙烯腈 (PAN) *
|
*注:多达 200 种芯片,可根据用户要求定制芯片表面
(四)生物材料与人体组织的相互作用
植入体和生物材料在人体内的生物相容性是它们成功发挥作用的关键。QSense提供了在分子层面对植入体表面或生物材料与人体血液和组织相互作用的体外分析。
- 各种眼部护理配方与黏蛋白/细胞膜表面的相互作用[20]。
(五)生物传感器开发
QSense也被广泛用于蛋白质生物传感器和即时检测传感器等类型传感器的开发中。
- 蛋白质生物传感器[21],[22]
- 即时检测传感器(Point-of-care sensors)[23]
QSense QCM-D是一种表面敏感技术,可在纳米尺度上检测分子-表面的相互作用。它可用于分析吸附、解吸附和表面附着层结构变化等现象。
QSense基于 QCM-D 技术
耗散型石英晶体微天平(QCM-D)是一种实时、表面敏感的技术,可以用于分析表面相互作用现象、薄膜形成和薄膜特性。
探索 QCM-D
QSense Omni 耗散型石英晶体微天平
QSense Omni 是由QCM-D技术的先驱者瑞典百欧林科技有限公司推动研发的最新一代耗散性石英晶体微天平型号,是QCM-D最新技术的集大成者。Omni比市面上任何一款QCM的灵敏度都要高,这使它能够量化和监测更小的分子、更快的过程,是研究生物过程非常理想的工具。QSense有超过 200多种芯片表面材料和涂层可供选择,支持模拟真实生物环境和过程,以表征蛋白质吸附速率、薄膜形成、吸附层刚性、钙化、细胞附着等。

QSense Omni 耗散型石英晶体微天平
- 能够检测芯片表面微小至24 ng/cm²的变化
- 更快的流体交换(5倍于上代产品),提供更快和更清晰的样品输送
- 全系列自动化功能,最小化用户依赖性
- 更简化的工作流程和全新直观的软件界面,使更广泛的用户可以更加容易地使用QCM-D。
QSense优势
- 直观、自动化的实验台仪器
- 易于在实验室中实施
- 蛋白质相互作用的实时数据
- 充分了解交互过程和机制
- 所需样品量低至 90μl
- 从少量样本中获得有价值的结果
- 几小时内即可获得结果
- 快速显示最终结果
- 可预编程的标准脚本
- 易于设置和重现测量
多种芯片可选

用于生物制药的QSense芯片
QSense芯片使您能够测量多种用于抗体和其他生物药物的生产、储存和给药相关的相关表面材料的相互作用——从金属、玻璃材料到聚合物,例如不锈钢、硼硅酸盐玻璃和生物级聚合物。

QSense PDMS 芯片
PDMS是润滑注射器和类似实验室器具的极好选择,在这些器具中,保持存储液体和生物样品的完整性至关重要。此外,其热绝缘和电绝缘特性可保护敏感样品和部件。
发现满足您需求的芯片
芯片是 QCM-D 实验的核心。浏览市场上种类最齐全的芯片,找出哪种芯片材料和涂层最适合您的研究需求。
(六)用于包衣片制造的润湿性表征
药片上的涂层有多种用途。 涂层用于掩盖口味或气味、保护药物免受胃酸环境的侵蚀或保护胃内膜免受侵袭性药物的侵害。也可以设计涂层以控制药物的释放特征。 无论出于何种原因,涂层被应用于片剂核心,并且成功的前提之一是涂层与片剂的良好粘附性。
为确保良好的粘附性,涂层制剂应完全铺展在片剂表面上。 如果有一些渗透到片剂的孔隙中,粘合力会增强。 可以通过接触角和表面自由能测量来评估涂层制剂在片剂表面上的铺展。 由于表面孔隙度也起作用,结合表面粗糙度测量和确定粗糙度校正的接触角可以给这个问题提供更多的了解。
在某些情况下,由于会改变润湿性质,所以无法将药物压缩成片剂形式。 Washburn法因此经常用于确定药物化合物的接触角。 Washburn法也被用于研究干法聚合物涂层等工艺中的润湿性,其中聚合物粉末与不同添加剂的接触角是令人感兴趣的。
(七)药物化合物的接触角测量
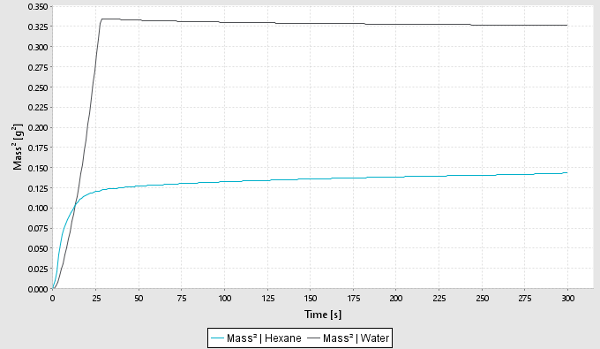
制药工业通常使用不同的粉末作为药物化合物,因此了解粉末的润湿行为对制药工业非常重要。
粉末的润湿性可以采用Sigma 700/701用Washburn方法来测量。 在Washburn法中,根据粉末与液体接触时重量随时间的增加计算得到接触角。
参考文献
[1] Small-molecule-mediated control of the anti-tumour activity and off-tumour toxicity of a supramolecular bispecific T cell engager Nat. Biomed. Eng 2024, 8 (5), 513–528. https://doi.org/10.1038/s41551-023-01147-6.
[2] Genentech– Viscoelastic characterization of high concentration antibody formulations using quartz crystal microbalance with dissipation monitoring Journal of Pharmaceutical Sciences 2009, 98 (9), 3108–3116.
https://doi.org/10.1002/jps.21610.
[3] Roche– Reconstitution and Functional Analysis of a Full-Length Hepatitis C Virus NS5B Polymerase on a Supported Lipid Bilayer ACS Cent. Sci. 2016, 2 (7), 456–466. https://doi.org/10.1021/acscentsci.6b00112.
[4] A Fast and Reliable Method Based on QCM-D Instrumentation for the Screening of Nanoparticle/Blood Interactions Biosensors 2023, 13 (6), 607. https://doi.org/10.3390/bios13060607.
[5] A QCM-D and SAXS Study of the Interaction of Functionalised Lyotropic Liquid Crystalline Lipid Nanoparticles with siRNA ChemBioChem 2017, 18 (10), 921–930. https://doi.org/10.1002/cbic.201600613.
[6] Helper lipid structure influences protein adsorption and delivery of lipid nanoparticles to spleen and liver Biomater. Sci. 2021, 9 (4), 1449–1463.
https://doi.org/10.1039/D0BM01609H.
[7] AstraZeneca – Screening of the binding affinity of serum proteins to lipid nanoparticles in a cell free environment Journal of Colloid and Interface Science 2022, 610, 766–774. https://doi.org/10.1016/j.jcis.2021.11.117.
[8] Insights into the mechanisms of interaction between inhalable lipid-polymer hybrid nanoparticles and pulmonary surfactant Journal of Colloid and Interface Science 2023, 633, 511–525.
https://doi.org/10.1016/j.jcis.2022.11.059.
[9] On the interactions between RNA and titratable lipid layers: implications for RNA delivery with lipid nanoparticles Nanoscale 2024, 16 (2), 777–794.
https://doi.org/10.1039/D3NR03308B.
[10] Genentech – Adsorption and Aggregation of Monoclonal Antibodies at Silicone Oil–Water Interfaces Mol. Pharmaceutics 2021, 18 (4), 1656–1665. https://doi.org/10.1021/acs.molpharmaceut.0c01113.
[11] Bristol-Myers Squibb – Mechanistic Understanding of Protein-Silicone Oil Interactions Pharm Res 2012, 29 (6), 1689–1697.
https://doi.org/10.1007/s11095-012-0696-6.
[12] Bristol-Myers Squibb – Adsorption of polypropylene oxide-polyethylene oxide type surfactants at surfaces of pharmaceutical relevant materials: effect of surface energetics and surfactant structures Pharmaceutical Development and Technology 2019, 24 (1), 70–79. https://doi.org/10.1080/10837450.2018.1425431.
[13] Bristol-Myers Squibb – Particle Characterization for a Protein Drug Product Stored in Pre-Filled Syringes Using Micro-Flow Imaging, Archimedes, and Quartz Crystal Microbalance with Dissipation AAPS J 2017, 19 (1), 110–116.
https://doi.org/10.1208/s12248-016-9983-1.
[14] Pfizer – Engineering a ceramic piston pump to minimize particle formation for a therapeutic immunoglobulin: A combined factorial and modeling approach. J Adv Manuf & Process 2023, 5 (1), e10142.
https://doi.org/10.1002/amp2.10142.
[15] Antibody adsorption and orientation on hydrophobic surfaces Langmuir 2012, 28 (3), 1765–1774.
https://doi.org/10.1021/la203095p.
[16] AstraZeneca– The Impact of the Metal Interface on the Stability and Quality of a Therapeutic Fusion Protein Mol. Pharmaceutics 2020, 17 (2), 569–578. https://doi.org/10.1021/acs.molpharmaceut.9b01000.
[17] Janssen Pharmaceuticals (Johnson and Johnson) – Quartz Crystal Microbalance as a Predictive Tool for Drug-Material of Construction Interactions in Intravenous Protein Drug Administration Journal of Pharmaceutical Sciences 2023, 112 (12), 3154–3163. https://doi.org/10.1016/j.xphs.2023.07.019.
[18] Eli Lilly – Surface Interactions of Monoclonal Antibodies Characterized by Quartz Crystal Microbalance with Dissipation: Impact of Hydrophobicity and Protein Self-Interactions Journal of Pharmaceutical Sciences 2012, 101 (2), 519–529.
https://doi.org/10.1002/jps.22771.
[19] Bristol-Myers Squibb – Overview of the Impact of Protein Interfacial Instability on the Development of Biologic Products In Protein Instability at Interfaces During Drug Product Development; Li, J., Krause, M. E., Tu, R., Eds.; AAPS Advances in the Pharmaceutical Sciences Series; 2021; Vol. 43, pp 1–8.
https://doi.org/10.1007/978-3-030-57177-1_1.
[20] Novartis Pharma – Understanding the adsorption and potential tear film stability properties of recombinant human lubricin and bovine submaxillary mucins in an in vitro tear film model Colloids and Surfaces B: Biointerfaces 2020, 195, 111257. https://doi.org/10.1016/j.colsurfb.2020.111257.
[21] Dual-mode and Label-free Detection of Exosomes from Plasma Using an Electrochemical Quartz Crystal Microbalance with Dissipation Monitoring Anal. Chem. 2022, 94 (5), 2465–2475. https://doi.org/10.1021/acs.analchem.1c04282.
[22] Amplified QCM-D biosensor for protein based on aptamer-functionalized gold nanoparticles Biosensors and Bioelectronics 2010, 26 (2), 575–579. https://doi.org/10.1016/j.bios.2010.07.034.
[23] Bioactivated PDMS microchannel evaluated as sensor for human CD4+ cells – The concept of a point-of-care method for HIV monitoring. Sensors and Actuators B: Chemical 2007, 123 (2), 847–855.
https://doi.org/10.1016/j.snb.2006.10.034.
[24] Apolipoprotein E Binding Drives Structural and Compositional Rearrangement of mRNA-Containing Lipid Nanoparticles. ACS Nano 2021, 15 (4), 6709–6722. https://doi.org/10.1021/acsnano.0c10064.
[25] Development of Nanopackaging for Storage and Transport of Loaded Lipid Nanoparticles. . Nano Lett. 2023, 23 (14), 6760–6767.
https://doi.org/10.1021/acs.nanolett.3c01271.
[26] Review of structural design guiding the development of lipid nanoparticles for nucleic acid delivery. Current Opinion in Colloid & Interface Science 2023, 66, 101705. https://doi.org/10.1016/j.cocis.2023.101705.
[27] QCM-D Investigations on Cholesterol–DNA Tethering of Liposomes to Microbubbles for Therapy. J. Phys. Chem. B 2023, 127 (11), 2466–2474.
https://doi.org/10.1021/acs.jpcb.2c07256.
[28] Thermo-responsive lipophilic NIPAM-based block copolymers as stabilizers for lipid-based cubic nanoparticles. Colloids and Surfaces B: Biointerfaces 2022, 220, 112884. https://doi.org/10.1016/j.colsurfb.2022.112884.