【研究背景】
对于电化学能源储存的发展来说,区分并理解电化学储能机理非常重要。我们常通过循环伏安法(CV曲线的形状)来区分各种不同的能量储存机理。比如:对于电池来说,其CV曲线存在成对的尖锐的氧化还原峰,且氧化峰和还原峰之间的电位差较大;对于赝电容来说,典型的CV曲线中会出现宽化的氧化还原峰,强度较弱并且氧化峰和还原峰之间的电位差几乎为零;而对于双电层电容而言,其储能过程中并无氧化还原反应发生,因此其CV曲线为矩形且无氧化还原峰。Ti3C2 MXene,一种新型的二维过渡金属碳化物,在酸性水溶液和有机电解液中均展现出超高的电容和优秀的倍率性能(Nature Energy 2, 17105;Nature Energy 4 (3), 241-248),并且在其CV曲线上都可以观察到对称且明显的氧化还原峰,对应于在材料表面发生的快速可逆的氧化还原赝电容过程。与酸性或者有机电解液相比,水系中性电解液更为安全,环保且价格低廉,因此有着广泛的应用前景。然而在中性的水溶液中,Ti3C2的CV曲线几乎都呈现类矩形并且缺乏可见的氧化还原峰,对应于较低的赝电容占比,因此虽然具有优秀的倍率性能,其容量却相对较低。如果在中性水溶液中实现强的赝电容嵌入,对于MXene在储能领域的发展则是非常有吸引力。
【成果简介】
近日,美国Drexel大学Yury Gogotsi教授团队在二维MXene基中性水系超级电容器中观察到了两种特殊充放电过程,并通过先进表征手段揭示了其与已知中性体系中迥异的高赝电容占比的电化学机理,相关研究先后报道在ACS Nano 和 ACS Energy Letters上。文章的第一作者均为Xuehang Wang博士(现入职代尔夫特理工大学助理教授,博士生导师)。其中ACS Energy Letters共同一作为美国布鲁克海文国家实验室的Seongmin Bak博士。
【内容详情】
Ti3C2在高于0.3 V (vs Ag/AgCl) 的电位下会发生明显的氧化现象,因此目前对其电化学性能的研究均集中在负的电压范围内。在ACS Nano的文章中,作者观察到Ti3C2在饱和LiCl溶液(19.8 m)中的正向电压窗口大幅增大,使得探索Ti3C2在正向充放电时的电化学现象成为可能。如图1所示,作者发现在正向充放电时,Ti3C2在饱和LiCl水溶液中的CV曲线上出现了一对新的明显的氧化还原峰,并且氧化电位和还原电位之间相差较大。同样的,在饱和LiBr (19.2 m)和饱和LiTFSI (15 m)的水溶液中,作者也观察到了相同的现象。根据CV曲线的形状,作者首先猜测,这可能为一个电池型的充放电过程。并且根据氧化还原峰出现在比开路电压更正的位置合理推测这个过程很有可能是由于阴离子嵌入造成的 。

图1. Ti3C2 MXene 在19.8 m LiCl, 3 M H2SO4 and 1 M LiCl电解液中的2mV/s循环伏安图。
为了探究这一假设的合理性,作者首先通过原位X射线衍射观察Ti3C2层间距 (002峰的位置)随着电压的变化。作者发现,当充放电过程进行至该氧化还原峰开始出现的电位时,MXene的层间距会发生一个剧烈的突变(图2a)。有意思的是,当电压往正向扫时,层间距在氧化峰起始位置剧烈减小;而向负向扫的过程中,层间距在还原峰起始位置则突然增大。这与阴离子嵌入的假设是正好相反的。并且,当替换Cl离子为更大的TFSI离子时,其层间距随电压变化的趋势是相同的。这进一步证明了正电压下发生的电化学过程是由于阳离子,也就是Li离子的嵌入脱出而导致的。同时,作者通过可见光吸收谱发现Li+离子的嵌入脱出并不伴随有明显的氧化还原:由于H+离子的表面氧化还原发生在 -0.5 V (vs. Ag) (图1),Li离子表面氧化还原则应该发生在更负的电压,说明这并不是一个传统的电池充放电过程,且与已知的Li离子的赝电容嵌入脱出也并不相同。
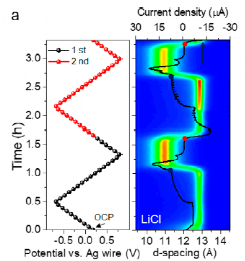

图2. (a) 原位X光衍射谱:Ti3C2 层间距在19.8 m LiCl 电解液中随0.5 mV/s循环伏安扫描的变化。(b) 电化学石英晶体微天平:Li离子和水分子嵌入引发的共振频率(Δf/n)的变化。
为了理解这个特殊的过程,作者采用了电化学石英晶体微天平来定量观察MXene层间的质量随电压的变化(图2b)。作者观察到随着电压正扫,MXene层间的质量持续下降。并且在氧化峰峰位处,MXene层间的质量急速降低,对应锂离子的脱出,这也就解释了X光衍射观察到在该电压下层间距剧烈减小的过程。而随着电压负扫,层间质量的变化过程则刚好相反,与X射线衍射结果相对应。在非氧化还原峰位处,MXene层间质量虽有变化,但速度都较为缓和。通过进一步定量分析质量的变化,我们发现电极电势处于非氧化还原峰位时,每个嵌入脱出的锂离子携带1-1.5个水分子,与已知文献报导相吻合。而在氧化还原峰位处,每个Li离子的嵌入脱出则携带了3个水分子,与饱和LiCl溶液中Li离子的溶剂化程度一致,因此并无传统的去溶剂化现象发生。通过理论计算,作者关联了X射线衍射与层间水分子的得失,与电化学石英晶体微天平观测的结果一致。

图3. 图示在Ti3C2 MXene-饱和水系电解液中典型赝电容嵌入和反去溶剂化嵌入的区别。
图3显示了Ti3C2 MXene在饱和LiCl电解液中的充放电机理。CV曲线上非氧化还原峰的位置均表现为典型的赝电容Li离子嵌入,每个Li离子的嵌入脱出携带1-1.5个水分子,并且其嵌入脱出过程几乎不改变Ti3C2的层间距。而在氧化还原峰位处,Li离子则实现了反去溶剂化的大量,剧烈的嵌入脱出过程,每个Li离子携带的水分子数变成了3个,引起了在峰电压下提高的储锂能力。因此,作者不仅首次在中性水系MXene基超级电容器中观察到了类似于电池的现象,并且证明了这个过程与典型的电池与赝电容嵌入都不相同,与反脱溶的锂离子的嵌入脱出有关。
在ACS Energy Letters的论文中,通过改变Ti3C2中初始Ti原子的化合价,作者Ti3C2-中性水溶液体系中首次实现了负电压下的强表面氧化还原反应(图4)。在饱和LiBr水溶液中,Ti3C2在正电压下的抗氧化能力得到增强,在1.1 V的高电压下依旧不会剧烈氧化(TiO2)。利用这种优势,作者首先将Ti3C2在饱和LiBr水溶液中在0 - 1.2 V (vs. Ag) 的电压区间进行电化学充放电循环,实现了Ti3C2的缓慢氧化。三次充放电循环后,作者在-1.1 - 0.5V的电压区间进一步探索其在饱和LiBr中的电化学行为,并发现,与未氧化的Ti3C2相比,其在工作电压的负电压区间内出现了明显增强的且对称的一对氧化还原峰,使得Ti3C2的容量提高了约55%。

图4. 图示微氧化Ti3C2后,在Ti3C2-饱和中性水溶液中的负电压处观察到强表面氧化还原。
为了探索MXene微弱氧化后为何会增强负电压时的表面氧化还原反应,作者在美国布鲁克海文国家实验室对Ti3C2在饱和LiBr电解液中的充放电过程进行了原位X光吸收谱的测试。通过与TiO2和TiO的K-edge X射线吸收近旁结构谱图对比,在饱和LiBr中弱氧化的Ti3C2仍保留MXene的性质且并未被氧化成氧化钛(图5a)。其次, 根据Ti K-edge半峰高的能量,作者计算出了Ti在充放电过程中的价态变化。在微氧化的Ti3C2的充放电过程中,Ti的价态在2.86到2.76之间可逆变化(图5b)。因为整个过程存在电子得失(每个Ti原子可得失0.08个电子),所以微氧化的Ti3C2在饱和LiBr水溶液中的电化学过程被证实为表面氧化还原的赝电容。原位表面扩展X射线精细结构(EXAFS) 分析也被首次应用于Ti3C2以观察并区分不同的Ti和C之间距离随电压变化的趋势(图5c)。同样的,Ti-Ti,Ti1-C,Ti2-C的距离都在充放电过程中均发生可逆变化,进一步证实了表面氧化还原反应的发生。因此,通过微氧化Ti3C2,我们成功在中性饱和LiBr水溶液体系中实现了Ti3C2表面氧化还原的赝电容反应。

图5. (a) 微氧化Ti3C2,TiO2和TiO中Ti 的K-edge X射线吸收近旁结构谱图。(b) 微氧化Ti3C2中Ti 化合价与X光半峰高能量的线性关系。(c) 图示Ti3C2中原位表面扩展X射线精细结构谱观察的Ti−C, Ti−Ti1, and Ti−Ti2 键。
【总结】
作者通过引入MXene-饱和中性水系电解液体系,扩展了MXene电极的正向电压窗口,研究了新奇的反去溶剂化的充放电过程。同时,通过引入微氧化,拓展了Ti原子表面氧化还原窗口,提高了Ti3C2的快速储锂能力。Gogotsi团队在中性水系电解液的两篇文章,为发展大电压窗口和环境友好型MXene基高功率密度的电化学储能器件提供了新的思路。
参考文献
- Wang, S. Bak, M. Han, C. E. Shuck, C. McHugh, K. Li, J. Li, J. Tang, Y. Gogotsi. Surface redox pseudocapacitance of partially oxidized titanium carbide MXene in water-in-salt electrolyte. ACS Energy Letters, 2022, 7, 30-35.
- Wang, T. S. Mathis, Y. Sun, W. Tsai, N. Shpigel, H. Shao, D. Zhang, K. Hantanasirisakul, F. Malchik, N. Balke, D. Jiang, P. Simon, Yury Gogotsi, Titanium carbide MXene shows an electrochemical anomaly in water-in-salt electrolytes. ACS Nano, 2021, 15, 9, 15274–15284.
本文转载自能源学人